CRISPR/Cas9, una tecnica di editing genomico innovativa, è alla base del primo xenotrapianto compassionevole di un cuore di suino geneticamente modificato in un uomo affetto da una grave malattia cardiaca terminale. L’operazione, avvenuta pochi giorni fa nello University of Maryland Medical Center a Baltimora, negli Stati Uniti, può essere già dichiarata come un successo, in quanto il corpo del paziente non ha immediatamente rigettato l’organo geneticamente modificato dell’animale e ha continuato a funzionare con una certa regolarità. Un’operazione che segna un importante step nella ricerca sui trapianti uomo animale che potrebbe potenzialmente salvare milioni di vite.
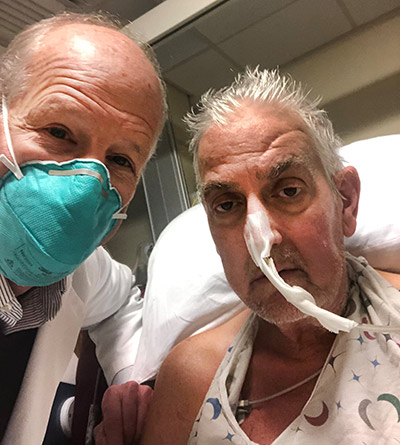
David Bennett, un tuttofare cinquantasettenne del Maryland, a causa della malattia cardiaca da cui è affetto, non era più idoneo per un trapianto con un cuore umano. Così, David ha coraggiosamente accettato di sottoporsi a questo intervento sperimentale pur sapendo che non ci fossero garanzie di successo. I medici e lo staff del centro, per eseguire l’intervento con una tecnica ancora in fase sperimentale, hanno dovuto infatti ottenere un permesso speciale dalle autorità regolatorie. Questo tipo di cura viene definita compassionevole.
La cura compassionevole
Per cura compassionevole si intende la possibilità di utilizzare un farmaco o una terapia che non ha ancora superato la fase di sperimentazione clinica. Un metodo utilizzato per quei pazienti che non hanno altre possibilità di cura. Nelle sperimentazioni cliniche vi sono alcuni gruppi di pazienti test a cui, ad esempio, invece del farmaco in studio, viene somministrato un placebo, per studiare al meglio le possibili reazioni. Con la cura compassionevole invece, si assicurano le più moderne e aggiornate possibilità di cura ai pazienti più gravi. Una possibile speranza di cura che è così aggiornata che non ha ancora superato la fase sperimentale. Nel caso di David Bennett si è trattato di uno xenotrapianto innovativo.
La storia degli xenotrapianti
Lo xenotrapianto, dal greco ξένος che significa estraneo, è un trapianto di organi, tessuti o cellule tra due organismi di specie diverse. Fin dalla fine dell’Ottocento, vi sono stati i primi studi di trapianti di tessuti e organi animali nell’uomo. Una pratica che addirittura ha preceduto il tentativo di eseguire trapianti tra membri della stessa specie, chiamati allotrapianti.
La ricerca medica negli anni a seguire, però si è concentrata principalmente sui trapianti tra esseri umani. Purtroppo recentemente, vi è stata una progressiva diminuzione nel numero di organi umani destinati ai trapianti. Per rispondere a questo grave problema, la ricerca si è nuovamente concentrata sugli xenotrapianti. Ricerca che è riuscita ad avanzare anche grazie ai più recenti studi nel campo dell’editing genetico. Questi studi hanno permesso ai ricercatori di modificare gli organi degli animali in modo che funzionino correttamente anche nel corpo degli esseri umani.
CRISPR/Cas9: il gene editing democratico
Una delle principali difficoltà degli xenotrapianti era il cosiddetto rigetto. Il corpo umano riconosceva come estraneo l’organo dell’animale rigettandolo e smettendo di farlo funzionare. Le più recenti scoperte nel campo del genome editing, la capacità di modificare parte delle sequenze di DNA nelle cellule animali o vegetali, potrebbero finalmente risolvere questo problema. Queste operazioni di “taglia e incolla” dei frammenti di DNA sono state possibili fin dagli anni Ottanta. Tuttavia, richiedevano molto tempo e sia dei laboratori ben attrezzati con macchinari avanzati, che una buona dose di fortuna, in quanto il risultato non era sempre garantito.
La scena dell’editing genomico è cambiata nel 2020, grazie alla creazione della “forbice molecolare” da parte della biochimica francese Emmanuelle Charpentier e la chimica americana Jennifer A. Doudna. Una creazione che è valsa loro il premio Nobel per la chimica 2020. Il metodo CRISPR/Cas9 è figlio di una lunga ricerca che discende da quasi 60 anni di studi, sin dalla scoperta della struttura a doppia elica del DNA nel 1953. Studi che sono avanzati anche grazie alla ricerca sul genoma dei batteri. Studiandoli infatti si è scoperta la presenza di una serie di sequenze ripetitive lunghe 25-50 coppie di basi (le unità fondamentali del DNA) che in alcuni casi contenevano delle brevi sequenze palindrome alternate a sequenze non ripetitive. Il nome scelto per queste strutture è stato CRISPR, clustered regularly short palindromic repeats, traducibile in italiano con brevi ripetizioni palindrome raggruppate e separate a intervalli regolari.
La svolta è arrivata da ulteriori studi su uno specifico meccanismo dei batteri per difendersi dai virus utilizzando un enzima chiamato Cas9. Questo enzima viene portato da un frammento di RNA in grado di raggiungere esattamente il bersaglio. La “forbice” sfrutta le sequenze CRISPR ed esegue lo stesso meccanismo che ogni giorno compiamo con il comando copia-incolla nei nostri computer. «Con questa tecnica abbiamo reso democratico il gene editing, cioè la capacità di modificare il genoma di una cellula o di aggiungere ed eliminare geni a piacimento» aveva commentato un paio di anni fa la professoressa Doudna «È così facile e poco costoso che qualunque laboratorio minimamente attrezzato può farlo».
Innovazione e futuro
I medici di Baltimora ora vigilano con attenzione le condizioni del paziente, che è già in grado di respirare da solo mentre è ancora connesso alle macchine per aiutare il suo nuovo cuore. Le prossime settimane saranno infatti fondamentali per capire se Bennett riuscirà a recuperare pienamente e se il suo nuovo cuore continuerà a funzionare. «Se questo funzionerà, ci sarà un’infinita scorta di organi per tutti i pazienti che ancora soffrono» ha dichiarato all’Associated Press il Dott. Muhammad Mohiuddin, il direttore scientifico del programma di trapianti animale-uomo dell’Università del Maryland.
Gli Stati Uniti però non sono i primi pionieri in questo campo. In Italia infatti, precisamente a Padova, il professor Gino Gerosa, Direttore dell’Unità Operativa di Cardiochirurgia dell’Azienda Ospedaliera Università di Padova, già nel 2020 era riuscito a creare il primo cuore bionico interamente Made in Italy. Uno studio che però necessita di fondi, come aveva già più volte dichiarato il professor Gerosa: «Siamo a un passo dallo scrivere un grande successo per la ricerca scientifica che potrebbe essere rinnovato motivo di orgoglio per il Paese. Ma è necessario muoversi e farlo rapidamente».
La ricerca e lo studio del professor Gerosa sono innovativi anche dal punto di vista etico. Tra i suoi programmi, vi è quello di riuscire a stampare completamente il cuore bionico con una stampante 3D, eliminando di fatto la necessità di prelevare l’organo da un animale vivo.
